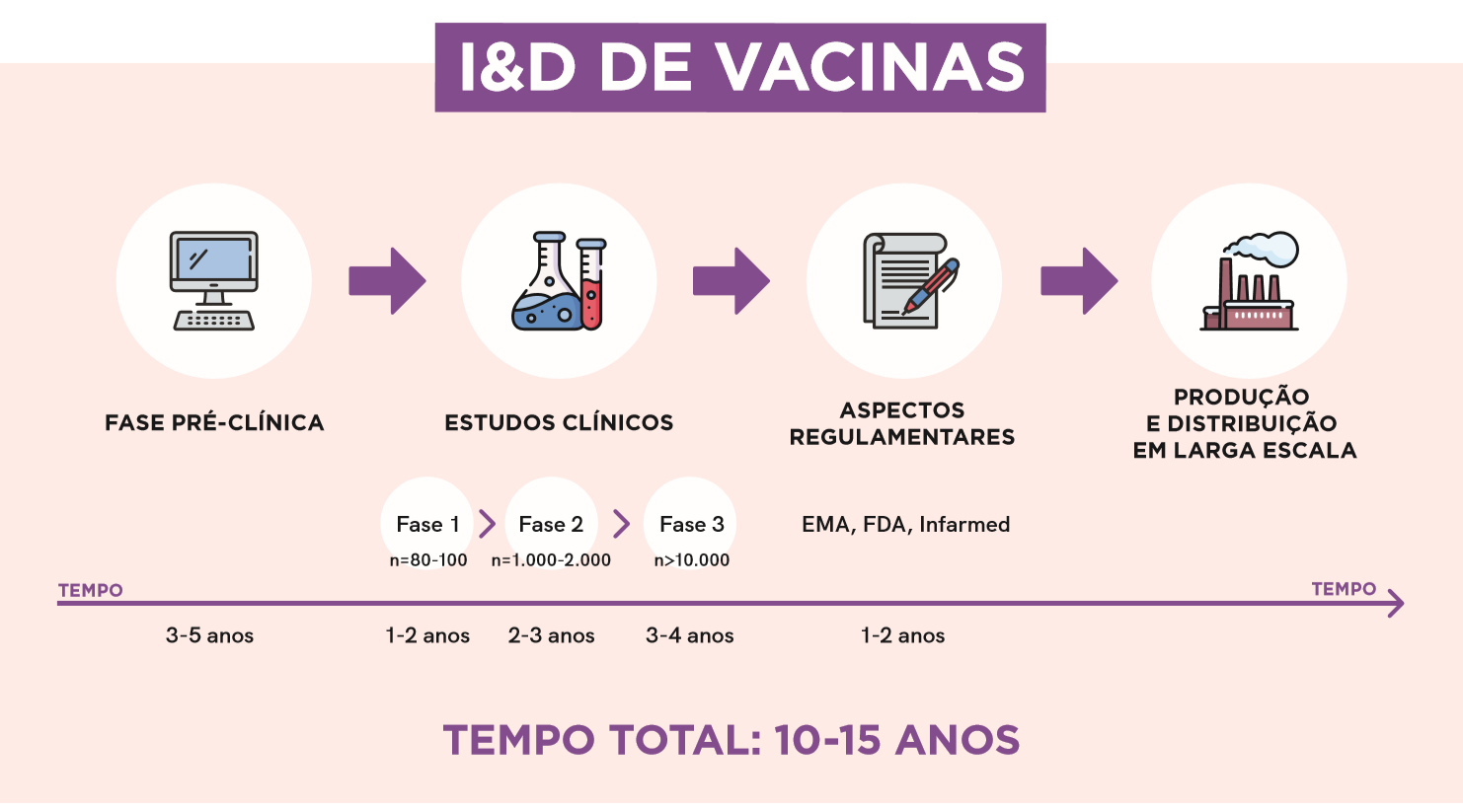
O desenvolvimento de medicamentos (vacinas ou não) obedece a um conjunto de fases. Estes passos têm objectivos diferentes, de modo a esclarecer o potencial benefício e o possível dano da sua administração. Os resultados de cada fase são cuidadosamente analisados antes de se passar à fase seguinte. Um estudo do Instituto de Saúde Baseada na Evidência (ISBE) identifica o processo:
- Fase pré-clínica: Estudos com modelos informáticos, experiências laboratoriais e em modelos animais, para determinação de potencial benefício e segurança na patologia específica que se quer tratar/prevenir.
- Fase 1: Administração do fármaco em doses variáveis, a 80-100 voluntários sem doença, para confirmação de segurança e determinação de eficácia (através do doseamento de anticorpos específicos neutralizantes).
- Fase 2: Administração do fármaco a 1.000-2.000 voluntários, focando acima de tudo aspectos de segurança, mas também de efectividade, numa amostra mais próxima da população à qual se vai destinar a vacina, em termos das suas características etárias, fisiológicas, epidemiológicas, etc. Esta amostra não tem habitualmente dimensão suficiente para a prova de eficácia/segurança final, que se consegue na fase 3.
- Fase 3: Realização dos estudos que servem de base à autorização de introdução no mercado. Embora se destinem a identificar também problemas de segurança, servem sobretudo para determinar a eficácia na redução de infecções nos indivíduos tratados (grupo experimental), quando comparados com os que não fazem a vacina em estudo (grupo de controlo). Nesta fase, as amostras são de grandes dimensões (dezenas de milhares de doentes).
- Fase 4: Recolha de dados de efectividade e segurança após introdução no mercado. No caso da Investigação & Desenvolvimento (I&D) de vacinas contra a COVID-19, foi possível ― devido a investimentos de maiores dimensões e tecnologias mais avançadas ― encurtar todas as fases de I&D.